人教版高一化学必修一第一章从实验学化学单元测试题
学习资料 2021-03-18 399
高一化学期中考试马上就要来了,大家在备考期中考试之余要做一些试题,这样能够提高大家对化学知识的掌握程度,还能丰富大家的解题经验,为此下面学大教育网为大家带来人教版高一化学必修一第一章从实验学化学单元测试题,希望对大家备考高一化学期中考试有所帮助。
一、选择题
1、每摩尔物质含有( )。
A. 6.02×1023个分子
B. 6.02×1023个原子
C. 阿伏加德罗常数个原子
D. 阿伏加德罗常数个该物质的粒子
2、下列说正确的是( )。
A.物质的量就是1摩尔物质的质量
B.1 mol水中含有2 mol氢和1 mol氧
C.1 mol气态水比1 mol液态水所含的分子数多
D.3 mol O2 与2 mol H2O中原子数相等
3、设NA代表阿伏加德罗常数,下列说法不正确的是( )。
A.14 g氮气所含原子数为NA
B.1 mol 水中所含电子数为10NA
C.32 g O2与32 g O3所含原子数分别为2NA和3NA
D.0.5 mol Na2CO3与1.5 mol H2O所含氧原子数目均为1.5NA
4、下列说法正确的是( )。
A.6.02×1023个碳原子的质量为1 g
B.钠原子的摩尔质量为23 g
C.HCl的摩尔质量等于6.02×1023个HCl分子的质量
D.Na2O2的摩尔质量为78 g/mol
5、在0.25 mol Na2O中,含有的氧离子数约为( )。
A. 1个 B. 0.25个 C. 1.5×1023个 D. 6.02×1023个
6、在一定量的NaHCO3中,氧原子与氢原子的物质的量之比是( )。
A. 1:1 B. 1:3 C. 3:1 D. 2:3
7、下列叙述正确的是( )。
A. 氢氧化钠的摩尔质量是40 g
B. 1 mol NaOH的质量是40 g/mol
C. 1 g H2和1 g N2所含分子数相等
D. 等质量的N2、CH4、CO、H2O中CH4所含分子数最多
8、下列物质中,含有0.4 mol氯离子的是( )。
A. 0.4 mol KClO3 B. 4/30 mol FeCl3 C. 3/40 mol FeCl3 D. 0.1 mol KCl
9、下列表述或叙述中,正确的是( )。
A.1 mol氢 B.3 mol H2 C.2 mol氢分子 D.1 mol H
10、已知a mol H2和b mol H2O中所含的原子个数相等,则a:b的值为( )。
A.1:1 B.1:3 C.3:2 D.任意比
11、一定量的氧气中含有1 mol电子,这些氧气的物质的量为( )。
A.1 mol B.0.5 mol C.0.125 mol D.0.0625 mol
12、已知3.2 g某气体中含有3.01×1022个分子,此气体的摩尔质量是( )。
A.32 g/mol B. 64 C. 64 g/mol D. 4 g
13、质量比为1:2的H2SO4和H3PO4,氢原子物质的量之比为( )。
A. 1:2 B. 1:3 C. 2:1 D. 3:4
14、 相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1; ②它们所含的O原子数目之比为1∶2; ③它们所含的原子总数目之比为2∶3; ④它们所含的C原子数目之比为1∶1;⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②和③ C.④和⑤ D.①②③④⑤
15、把0.5 mol Na和0.5 mol Mg分别投入到过量的m1 g水和m2 g盐酸中,分别得到溶液a和b。若m1=m2,则a与b的质量关系是( )。
A.ma>mb B.ma
16、足量的镁、锌、铁与含等物质的量HCl的稀盐酸反应,下列图象正确的是( )。

17.铜的摩尔质量为M g/mol,密度为d g/cm3,阿伏加德罗常数为NA,下列说法正确的是( )。
A.1 kg铜所含原子的数目为d NA
B.一个铜原子所占有的体积为(M/d)NA cm3
C.一个铜原子的质量为M/NA g
D.1 dm3铜所含有的原子数为 d NA/M
18.已知32 g X与40 g Y恰好完全反应,生成m g Q和9 g H。在相同条件下,16 g X和30 g Y混合反应生成0.25 molQ及若干摩尔H。则物质Q的摩尔质量应是( )。
A.63 g/mol B.122 g/mol C.126 g/mol D.163 g/mol
19.在反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O中,当有m g Cl2被氧化时,被还原的氯气是( )。
A.3m g B. 5m g C. 6m/35.5 mol D. 5m/71 mol
二、填空题
1.摩尔是表示 的单位,每摩尔物质均含有 个粒子。12g 12C中含有的碳原子数约为 个,1 mol H2O分子约含有 个电子,9 g H2O含有 mol电子。
2. 49 g磷酸(H3PO4)中有 mol H3PO4分子,含有 mol原子,与 g氢氧化钠恰好完全反应生成正盐。
3.等质量的碳酸钠与碳酸氢钠,分别与过量的盐酸反应时,产生的二氧化碳的物质的量之比是 。等物质的量的碳酸钠与碳酸氢钠与过量的盐酸反应时,消耗的HCl的物质的量之比是 ,产生的二氧化碳的质量比是 。
4.NO2的相对分子质量为a,NO的相对分子质量为b,则N2O的摩尔质量为(用a、b表示) 。
三、计算题
1.已知一个氧原子的质量为2.657×10-26kg,则多少克氧气的物质的量为1mol?(要求根据氧原子的质量进行推算)
2.与171 g Al2(SO4)3中所含的SO42-数目相同的Na2SO4的质量是多少?将171 g Al2(SO4)3和142 g Na2SO4混合,其混合物的平均摩尔质量是多少?
3.有CO与CO2的混合气体共33.6 L,其密度为1.726 g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是多少?CO与CO2的分子个数比是多少?
4.在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶3,则在含有2 mol SO
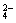
的混合物中,MgSO4的质量是多少克?
参考答案及解析
一、选择题
1.D 提示:摩尔是物质的量的单位,物质的量研究的对象是各种微粒,包括原子、分子、离子、质子、中子、电子等,所以A、B、C说法不完整,故D正确。
2.D 提示:物质的量是一定数目微粒的集体,与质量是不同的物理量,所以A错误。用摩尔表示物质的量时,应该用化学式指明粒子的种类,B选项中氢与氧表示的是元素种类,而不是粒子的种类,所以B错误。物质的量是一定数目微粒的集体,而物质微粒数目的多少与物质的状态无关,所以C选项中二者分子数目应相等。D选项中3 mol O2含6 mol 氧原子,2 mol H2O中含4mol 氢原子和2 mol氧原子,共6 mol原子,所以D正确。
3.C提示:一个水分子是由两个氢原子和一个氧原子构成的,而一个氢原子含1个电子,一个氧原子含8个电子,所以一个水分子含10个电子,即1 mol水中所含电子数为10 mol,即10NA,所以B正确。
4.D 提示:C选项中混淆了摩尔质量与质量这两个概念,摩尔质量与质量意义不同,单位也不相同,质量以g为单位,摩尔质量以g/mol为单位,1 mol物质的质量与该物质的摩尔质量只是在数值上相等,选项C错误。
5.C
6.C
7.D 提示:根据N=n×NA,即物质的微粒个数之比等于物质的量之比,C选项中1g H2和1 g N2的物质的量分别为0.5 mol和1/28 mol,所以分子数不相等。D选项中等质量的N2、CH4、CO、H2O中,先假设质量都为1g,则其物质的量分别为1/28 mol、1/16 mol、1/28 mol、1/18 mol,所以CH4的物质的量最大,其分子数最多。
8.B 提示:KClO3是由钾离子与氯酸根离子形成的离子化合物,其中不含氯离子。
9.BD 提示:物质的量对应的微粒要具体,且要用化学语言。
10.C
11.D
12.C 提示:根据n=N÷NA,所以n=3.01×1022÷6.02×1023 mol-1=0.05 mol 再由M=m÷n=3.2g÷0.05 mol=64 g/mol
13.B 提示:H2SO4和H3PO4的摩尔质量都是98 g/mol。根据n=m/M知,当摩尔质量相等时,其质量比就等于其物质的量之比,所以H2SO4和H3PO4的物质的量之比也为1:2,而1 mol H2SO4中含2 mol的氢原子,1 mol H3PO4中含3 mol的氢原子,所以其氢原子的物质的量之比是2:6=1:3。
14.D
15. C 提示:由于水和盐酸均过量,所以放出氢气的量要根据金属单质来算。根据化学方程式2Na+2H2O=2NaOH+H2↑、Mg+2HCl=MgCl2+H2↑可求得ma=mb。
16.D 提示:镁、锌、铁的金属活动性依次减弱,因此与盐酸反应的速率也依次减小,反映在图象中斜线的斜率也依次减小。由于金属是足量的,金属与盐酸反应会随着盐酸逐渐耗尽而反应停止,因此,最终产生氢气的质量取决于盐酸的质量。因为与含等质量HCl的盐酸反应,所以最终生成氢气的质量相等。
17.C 提示:1 kg铜物质的量为1000/M mol,所以含原子数为1000NA/M,故A错。1 mol铜的体积是M/d,1个铜原子所占有的体积为(M/d)/NA cm3,所以B错。1 mol铜的质量为M g,含NA个铜原子,1个铜原子的质量为M/NA g,即C正确。1dm3铜的质量是1000d g,铜的物质的量为1000d/M mol,所以含原子数目为1000dNA/M,即D错。
18.C 提示:由“32g X与40g Y恰好完全反应,生成m g Q和9 g H”和质量守恒定律可知,32 g +40 g =m+9 g,即m=63。32 g X与40 g Y恰好反应生成63 g Q,则16 g X能与20 g Y反应生成31.5g Q,可见,Y过量。又因为生成的Q为0.25 mol,即得M=m/n=31.5 g/0.25 mol=126 g/mol。
19.BD
二、填空题
1. 物质的量、阿伏加德罗常数、6.02×1023 、6.02×1024 、5
2. 0.5、4 、 60
3.42:53、2:1、1:1
4.(3b-a)g/mol
提示:NO2在组成上比NO多一个氧原子,所以(a-b)为氧的相对原子质量。由于NO的相对分子质量为b,则N的相对原子质量为[b-(a-b)]=(2b-a),所以N2O的相对分子质量为[2(2b-a)+(a-b)]=(3b-a)。
三、计算题
1.32 g
提示:因为1个氧分子含2个氧原子,1 mol O2约含6.02×1023个氧分子,所以有:2.657×10-26kg×2×6.02×1023=31.99×10-3kg=32.0 g。
2. 213g、208.67 g/mol
解析:(1)n[Al2(SO4)3]=m/M=171 g÷342 g/mol=0.5 mol
n(SO42-)=3×n[Al2(SO4)3]=3×0.5 mol=1.5 mol
m(Na2SO4)=1.5 mol×142 g/mol=213 g
(2) n[Al2(SO4)3]= m/M= 171 g÷342 g/mol=0.5 mol
n(Na2SO4)= m/M=142 g÷142 g/mol=1 mol
M(平均)= =(171 g+142 g)÷(0.5 mol+1 mol)=208.67 g/mol
3.38.67 g/mol;1:2
提示:m(总)=1.726g/L×33.6L=58g
n(总)=N÷NA=9.03×1023÷6.02×1023mol-1=1.5mol
M(平均)=m(总)÷n(总)=58 g÷1.5mol=38.67g/mol
又因为m(总)=[28n(CO)+44n(CO2)]g 、n(总)= [n(CO)+ n(CO2)]mol
所以有:M(平均)=m(总)÷n(总)=[ 28n(CO)+44n(CO2)]÷[n(CO)+ n(CO2)]mol=38.67g/mol
解得:n(CO): n(CO2)= 1:2
4.120 g
人教版高一化学必修一第一章从实验学化学单元测试题学大教育网为大家带来过了,大家在复习化学的过程中要养成好的做题习惯,这样就能不断的提高自己的解题水平,从而轻松应对化学期中考试。
文章来源于网络,如有版权问题请联系我们删除!
推荐阅读 高一化学必修一第一章从实验学化学知识点 人教版高一化学必修一非金属及其化合物单元测试题 高一化学必修一知识点总结:化学实验安全 高一化学第一章知识点:化学实验基本方法 高一化学必修一第二章单元测试题(含答案及解析) 高一化学必修一第一章知识点
点击访问更多新期教育网的 学习资料资讯
上一条: 人教版高一化学必修一非金属及其化合物单元测试题 下一条: 高一化学上学期期中考试有机化学易错知识点

暂无数据
